در جریان مطالعه کتاب درسی ، برای دانش آموزان کوشا و پرکار ، سوالاتی مطرح می شود که انتظار دارد پاسخ آن را داشته باشد ، برحی از این سوالات در دامنه شیمی معدنی قرار می گرفت پس تصمیم بر این گرفتم گه پاسخ این سوالات را در قالب مقاله ای و با تکیه بر مطالعات روزمره ارائه دهم ، البته این مقاله دائم در حال به روز شدن است .
سوال: طیف مواد رنگی ، از کدام نوع و به کدام شکل است ؟ و چه اهمیتی دارد ؟ در شیمی معدنی می خوانیم کخ طیف مواد رنگی از نوع طیف جذبی است و معمولا یه شکل خطی یا نواری و در طیف نگار به صورت پیک های جذبی پدیدار می شود . از این طیف ها برای شناسایی ساختار و خواص مواد استفاده می شود .
سوال : طیف جذبی چیست ؟طيف جذبي طيفي است كه به هنگام جذب پرتوهای الكترومغناطيسي توسط ماده توليد ميشود. يك طيف جذبي هنگامي توليد ميشود كه پرتوهای يك منبع خيلي گرم كه طيف پيوسته دارد، از ميان ماده سرد بگذرد. اين پرتوها در طول موج مشخصي جذب ميشوند
سوال : طیف نشری چیست ؟اگر یک ماده را از طریق حرارت دادن و یا با استفاده از قوس الکتریکی و یا یه هر طریق دیگر به شدت گرم کنیم ماده از خود نور تابش میکند ( پدیده نشر ) در صورتی که تابش نشرشده را از یک منشور عبور دهیم به طیف حاصله طیف نشری گفته می شود طیف نشری هم میتواند خطی یا پیوسته باشد .
سوال : آیا طیف های نشری و یا جذبی دو عنصر می تواند یکی باشد ؟ خیر ،هم در طيف نشری و هم در طيف جذبي هر عنصر ، طول موج هاي معيني وجود دارد كه از ويژگي هاي بارز و منحصر به فرد آن عنصر است. يعني طيف هاي نشری وجذبي هيچ دو عنصري مثل هم نيست.
سوال : کدام نوع طیف ها را می توان در آزمایشگاه ، بااستفاده از چراغ گاز و طیف نما به دست آورد ؟ طیف نشری فلزها و نمک ها را می توان به وسیله چراغ گاز و با استفاده از طیف نما به دست آورد که این نوع طیف را طیف شعله هم می نامیم و به شکل خطی یا نواری است . از طیف شعله می توان برای شناسایی کاتیون برخی فلزها در محلول به ویژه کاتیون فلزات قلیایی ( گروه اول ) و قلیایی خاکی ( گروه دوم ) استفاده کرد .
سوال : طیف نشری خطی هیدروژن ، چگونه ایجاد می شود ؟ می دانیم که اتم هیدروژن تنها دارای یک الکترون است واین الکترون در پایین ترین لایه انرژی آن یعنی مدار اول قرار دارد که به این حالت، حالت پایه می گویند . وقتی اتم هیدروزن را گرما دهیم ( انرژی دهیم ) الکترون آن تحریک شده و با جذب انرژی از تراز پایه به تراز های بالاتر انتقال می یابد این حالت را حالت برانگیخته می گویند . ولی الکترون در تراز های بالا ناپایدار بوده و با رها کردن انرژی جذب کرده به تراز های پایین تر بر می گردد و این بار انرژی کسب کرده را به صورت تابش بر می گرداند . می دانیم که در انتقال الکترون از تراز ششم به تراز پایه ، تعداد چهار نوار رنگی ایجاد می شود .
سوال : با استفاده از اعداد کووانتومی اصلی (n) و فرعی (l) چگونگی مسیر حرکت الکترون در زیرلایه های موجود در لایه سوم را توضیخ دهید ؟ در شیمی معدنی می خوانیم که رابطه میان اعداد کووانتومی n و l با نصف قطرهای کوچک تر (b) و بزرگ تر ( a) به صورت است که بر اساس این رابطه می توان دریافت که مسیرحرکت الکترون در زیرلایه 3d به شکل دایره و در زیرلایه های 3p و 3s به صورت بیضی خواهد بود که البته با کوچک تر شدن مقدار l این بیضی به صورت کشیده تر در میاید .
سوال : چگونه معلوم شد که در هر لایه اصلی n ، n زیرلایه وجود دارد؟ سامرفلد با توجه به رابطه : و در نظر گرفتن مسیرهای بیضی شکل برای چرخش الکترون به دور هسته ، و با توجه به حد نسبت
، توانست رابطه
را به دست آورد که بر اساس آن به ازای هر عدد کووانتومی n ، n عدد کووانتومی ( L ) را می توان برای الکترون در نظر گرفت .
سوال : رابطه های بوهر در مورد محاسبه سرعت ، شعاع و انرژی الکترون را در مورد اتم هیدروژن ، یون های هیدروژن مانند و اتم های چند الکترونی را بنویسید . در مورد اتم هیدروژن : سرعت
در مورد یون های هیدروژن مانند : سرعت
در مورد اتم های چند الکترونی : سرعت
شعاع حرکت الکترون در مورد اتم هیدروژن : که در این رابطه به جای
« جرم کاهش یافته الکترون » از m الکترون استفاده می کنیم . جرم الکترون برابر است با :
شعاع حرکت الکترون در مورد یون های هیدروژن مانند :
شعاع حرکت الکترون در اتم های چند الکترونی :
انرژی الکترون در مورد اتم هیدروژن :
انرژی الکترون در مورد یون های هیدروژن مانند :
انرژی الکترون در مورد اتم های چند الکترونی :
سوال : چرا گرافیت رسانای الکتریکی خوبی است در حالی که الماس چنین نیست ؟ می دانیم که هر دو دارای شبکه های نامحدود مرکب از اتم های کربن با پیوند کووالانسی هستند . دلیل رسانا بودن گرافیت این است که در شبکه بلور گرافیت ، یکی از اوربیتال های 2P تک الکترونی اتم کربن ناپیوندی است و این الکترون تا اندازه ای مانند الکترون آزاد فلزی می تواند در میدان الکتریکی به آسانی در شبکه بلور حرکت و روانه قطب مثبت جریان برق شود . ( اوربیتال : که جدیدا از کتاب درسی حذف شده ، یعنی فضایی از اطراف هسته که احتمال حضور الکترون در آن بیش از 90 درصد است . هر یک از زیرلایه های s , p , d به ترتیب از راست به چپ دارای 5 و 3 و 1 اوربیتال هستند که هر اوربیتال حداکثر با دو الکترون پرمی شود .
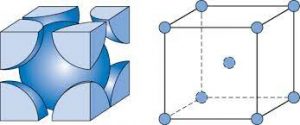
سوال : چگونه عدد کوئوردیناسیون فلز در سیستم مکعبی ساده برابر 6 است ؟ در سیستم مکعبی ساده ، هر اتم فلز که در راس سلول واحد مکعبی قرار دارد با شش اتم دیگر که با فاصله یکسان ( و کوتاه ترین فاصله ممکن ) در شش راس مجاور آن قرار دارد متصل است ، از این رو در سیستم مکعبی ساده عدد کوئوردیناسیون فلز برابر 6 است .
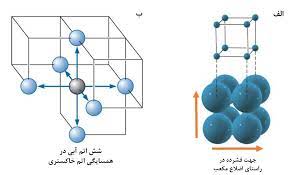
سوال : چگونه عدد کوئوردیناسیون فلز در سیستم مکعبی مرکز پر برابر 8 است ؟ در سیستم مکعبی مرکز پر ( مانند بلور فلزهای قلیایی ) هر اتم فلز که در مرکز سلول واحد مکعبی قرار دارد با هشت اتم دیگر که با فاصله یکسان ( و کوتاه ترین فاصله ممکن ) در هشت راص مکعب قرار دارند ، متصل است از این رو در سیستم مکعبی مرکز پر ، عدد کوئوردیناسیون فلز برابر 8 است .
سوال : پدیده ابررسانایی چیست ؟ به رسانایی الکتریکی شدیدی گفته می شود که در برخی فلزها ، آلیاژ ها یا ترکیب های فلزها در دماهای پایین ( نزدیک به صفرمطلق ) بر اثر از بین رفتن مقاومت الکتریکی و نفوذپذیری مغناطیسی آنها دیده می شود و محدوده دما بسته یه ماهیت این گونه مواد بین 0.5 تا 18 کلوین ممکن است تغییر کند . خاصیت ابر رسانایی به طور عمده در فلزهایی مشاهده می شود که لایه ظرفیت اتم آنها شامل 3 ، 5 و 7 الکترون باشد و مقاومت الکتریکی آنها در دمای معمولی زیاد باشد . ( مانند تالیم ، لانتان ، ایتریم ، بیسموت )
سوال : ابررساناها در چه مواردی کاربرد دارند ؟ امروزه اکثرا از ابر رسانا های دمای پایین استفاده می شود و مهم ترین کاربرد آنها در آهنرباهای ویژه طیف سنج های رزونانس مغناطیسی هسته ، آهنربای ویژه تشخیص پزشکی ، شتاب دهنده های ذره ها ، ترن های سریع اسیر مغناطیسی ، انواع ابزارهای رسانایی الکرتیکی
سوال : چرا واکنش ترمیت : به شدت گرماده است ؟دلیل عمده گرماده بودن واکنش ترمیت این است که آلومینیم اکسید ترکیبی بسیار پایدار بوده و سطح انرژی آن بسیار پایین تر از سطح انرژی اکسیدهای آهن و کروم است .
سوال : مفهوم شعاع بوهرچیست و در چه مواردی استفاده می شود ؟ فاصله نخستین مدار ایستاده ( n=1 ) تا هسته را در اتم هیدروژن که برابر 53 پیکومتر است ، در اصطلاح شعاع بوهر می گویند و آن را با نماد نشان می دهند . از به عنوان واحدی برای تعیین اندازه شعاع اتمی ، شعاع یونی و طول پیوند و غیره استفاده می شود .
سوال : فاصله بین تراز حالت پایه و سومین تراز بر انگیخته را در اتم هیدروژن برحسب حساب کنید . تراز جالت پایه یعنی n=1 و سومین تراز برانگیخته بعنی n=4 پس می توان نوشت که :
سوال : فاصله بین نخستین و سومین تراز برانگیخته را در اتم هیدروژن برحسب و pm ( پیکومتر ) و تفاوت سرعت حرکت الکترون را در این دو تراز برحسب سانتی متر بر ثانیه حساب کنید . تخستین تراز بر انگیخته یعنی n=2 و سومین تراز برانگیخته یعنی n=4 پس داریم
در مورد تفاوت سرعت حرکت الکترون در این دو تراز می توان نوشت که :
می توان گفت که هر چه شماره تراز بالاتر باشد ،
سرعت حرکت الکترون کاهش می یابد .
سوال : چرا نظریه بوهر در توجیه چندگانگی خط های طیفی اتم هیدروژن نارسانایی داشت ؟ علت نارسایی نظریه بور در توجیه حط های طیفی اتم هیدروژن این بود که بوهر فقط یک جهش منحصر به فرد برای الکترون بین دو سطح انرژی معین را در نظر گرفته بود که بر اساس آن ، مشاهده چندین خط طیفی نزدیک به هم که به جهش های الکترونی متفاوت نزدیک به هم بین دو سطح انرژی مربوط است ، قابل توجیه نبود یعنی در نظر رگفتن یک عدد کووانتومی n برای مشخص کردن کامل انرژی الکترون در اطراف هسته اتم کافی نیست .
سوال : pH خون چه تاثیری بر فشارجزئی گاز اکسیژن جذب شده به وسیله هموگلوبین دارد ؟ طبق اثر بور ( اثری که در باره وضعیت تعادلی هموگلوبین – اکسیژن در ارتباط با pH خون که توسط بور کشف شد . ) هرچه pH خون بالاتر باشد درصد سیرشدن هموگلوبین از اکسیژن نیز بالاتر می رود وبر عکس ، هرجه این فشار جزئی پایین تر بیاید اکسیزن بیشتر از هموگلوبین آزاد می شود ، علت این رویداد این است که هموگلوبین ضمن جذب اکسیژن یونش می یابد یعنی به ازای هر مولکول اکسیژن که جذب می کند ، یک پرتون آزاد می سازد . در محیط قلیایی ( pH بالا ) هموگلوبین اکسیژن جذب می کند و گونه های اکسیژن دار زیر را به وجود می آورد .
در محیط اسیدی ( pH پایین ) هموگلوبین پروتون یا Hمثبت جذب می کند و به کاتیون تبدیل می شود سپس این کاتیون ضمن جذب یک مولکول اکسیژن ، پروتون یا H مثبت خود را از دست می دهد .
سوال : قانون وانتهوف در باره ارتباط تاثیر دما بر سیستم های تعادلی چگونه است ؟ اگر در یک سیستم تعادلی دما را تغییر دهیم ، حالت تعادل تغییر می کند ، افزایش دما ، تعادل را در جهتی با جذب گرما ( گرما گیر ) است هدایت می کند . ولی کاهش دما ، تعادل را در جهتی که با آزاد شدن گرما ( گرماده است ) هدایت خواهد کرد . در سیستم تعادلی : واکنش در حهت تجزیه گرماگیر است بنابر قانون وانتهوف ، افزایش دمای سیستم سبب جابه جایی تعادل در جهت پیشرفت تجزیه HI می شود ، و اگر سیستم را سرد کنیم تعادل در جهت تشکیل مقداری از HI جا به جا می شود . یعنی مقداری از
و
با هم ترکیب می شوند .
سوال : قانون وانتهوف در باره فشار اسمزی را بیان کنید . « فشار اسمزی یک محلول ، برابر فشاری است که به وسیله ماده حل شده اعمال می شود و برابر فشاری است که آن ماده حل شده دارا می باشد ، چنانچه در حالت گازی در همان دما ، حجمی برابر حجم آن محلول را اشغال می کرد » البته این قانون نیز مانند قانون های رائول ( در باره نزول نقطه انجماد یا دمای جوش محلول ها ) در مورد محلول های رقیق و غیر الکترولیت صدق می کند . هرچه محلول غلیظ تر باشد ، و یا الکترولیت قویتر باشد ، انحراف بیشتری نشان می دهد .
محلول هایی که فشار اسمزی برابر دارند ، ایزوتونیک نامیده می شوند . رابطه فشار اسمزی مشابه رابطه فشار گازهای ایده آل است یعنی می توان نوشت :
مثال : فشار اسمزی محلول 9 گرم در لیتر گلوکوز را در دمای 27 درجه سلسیوس بر حسب اتمسفر حساب کنید .
سوال : استفاده از قانون هس در مورد محاسبه غیر مستقیم واکنش های شیمیایی چگونه است ؟ قانون هس بیان می کند که « اثر گرمایی یک واکنش شیمیایی ، تنها به به شرایط آغازی و پایانی اجسام واکنش دهنده بستگی دارد و به مرحله های حدواسط آن واکنش بستگی ندارد .مثلا اندازه گیری گرمای واکنش تشکیل « سدیم سولفات » از واکنش سولفوریک اسید
و سدیم هیدروکسید
به دو روش امکان دارد که اولی در یک مرحله و دومی در دو مرحله انجام می گیرد .
روش اول : با مخلوط کردن محلول رقیق ، شامل دو مول سدیم هیدروکسید با یک مول سولفوریک اسید ، از نظر شیمیایی و اثر گرمایی این فرایند شیمیایی می توان نوشت :
روش دوم : با افزودن یک محلول شامل یک مول سدیم هیدروکسید به یک محلول شامل یک مول سولفوریک اسید که به تشکیل نمک اسیدی سدیم هیدروژن سولفات منتهی می شود و سپس افزودن یک مول دیگر سدیم هیدروکسید به این نمک اسیدی حاصل شده ، که در مورد معداله شیمیایی و اثرگرمایی این فرایند می توان نوشت . از قانون هس برای اندازه گیری گرمای واکنش هایی که اندازه گیری مستقیم آنها امکان پذیر نیست ، استفاده می شود .
همان طور که ملاحظه می کنید می توان یک واکنش کلی را که گرمای حاصل از آن مشخص است ، به چند واکنش فرعی ( چند مرحله ای ) تقسیم کرد ، سپس جمع جبری گرمای حاصل از این مراحل فرعی را برابر گرمای واکنش کلی قرار داد .
سوال : تغییرات شعاع اتمی و یونی را در هر دوره و گروه از جدول دوره ای عناصر بیان کنید . در هر دوره از چپ به راست شعاع اتمی کاهش می یابد و در هر گروه با زیاد شدن لایه ها ، شعاع اتمی افزایش می یابد . در کل در هر دوره از چپ به راست شعاع یونی کاهش می یابد . البته از گروه اول تا چهاردهم عناصر اصلی ، شعاع یونی کاهش و باز دوباره بعد از یک افزایش تا گروه هفدهم کاهش می یابد : و
سوال : تغییرات الکترونگاتیوی عناصر در هر دوره و گروه از جدول دوره ای چگونه است ؟ الکترونگاتیوی یعنی تمایل اتم به جذب جفت الکترون های پیوندی ، پس در هر دوره از جدول با کاهش شعاع اتمی ، الکترونگاتیوی افزایش می یابد ، و در هر گروه از جدول با افزایش شعاع اتمی ، الکترونگاتیوی کاهش می یابد . البته در این روند یک سری استثنا هم به چشم می خورد به طور مثال میزان الکترونگاتیوی آلومینیم از گالیم کمتر است .
سوال : مفهوم الکترون خواهی اتم چیست ؟ الکترون خواهی یکی از خواص بنیادی اتم آزاد ( در حالت گازی ) است . و نشان دهنده تمایل اتم گازی به دریافت الکترون و تبدیل شدن به یون منفی گازی شکل است . که این فرانید برخلاف یونش اتم ها که همواره با جذب انرژی همراه است ، در جریان الکترون خواهی می تواند انرژی جذب یا آزاد شود . در اتم هایی که نیم واکنش الکترون خواهی اول آنها با آزاد شدن انرژی همراه است ، نیم واکنش دومین و یا سومین الکترون خواهی اتم فرایندی انرژی گیر خواهد بود .
اندازه گیری الکترون خواهی عناصر به طور مستقیم جز در موارد نادر ، غیر عملی است .از این رو باید آن را با استفاده از یک روش ترمودینامیکی به طور غیر مستقیم به دست آورد . که در این روش از چرخه « بورن – هابر » که بر « قانون هس » استورا است ، استفاده می شود .



برای نوشتن دیدگاه باید وارد بشوید.