قانون هایی که به ویژگی های عمل انجماد و تاثیر عامل های بیرونی بر نقطۀ انجماد مربوط هستند ، چنین بیان می شوند
-قانون اوّل : در فشار معیّن، هر مایع ، در دمای معینی آغاز به انجماد می کند که آن را دمای انجماد یا نقطۀ انجماد آن می نامند . اگر فشار برابر یک اتمسفر( جَو) باشد ، دمای انجماد هر مایع را نقطۀ انجماد نُرمال آن نیز می نامند . مثلاً آب در فشار یک اتمسفر در دمای صفر درجه سلسیوس آغاز به یخ زدن می کند . ( منجمد می شود . )
-قانون دوّم : دمای منجمد شدن یک مایع خالص ، در تمام زمان انجماد آن ثابت می ماند .
-قانون سوّم : ضمن منجمد شدن مایع ها ، به طور کلی حجم آنها کاهش می یابد .
( زیرا عمل منجمد شدن گرماده بوده و با کاهش سطح انرژی مواد ، از دامنه و شدّت جنبش های مولکولی کاسته می شود و میزان بی نظمی کاهش می یابد . این تغییرها با افزایش نظم و کاهش فاصلۀ بین مولکولی همراه است و سرانجام به سمت بلوری شدن کشیده می شود . ) مگر در مورد چند مایع ، که به هنگام یخ زدن، به علّت تشکیل ساختار بلوری باز ، حجم افزایش می یابد . مانند آب و بیسموت مایع که حالت باز شدن در ساختار آن به هنگام جامد شدن رخ می دهد .
-قانون چهارم :یک مول از هر مایع در فشار معیّن ، مقدار معینی گرما از دست می دهد تا بدون تغییر دما در همان دمای جامد شدن تغییر حالت دهد و از حالت مایع به حالت جامد تبدیل شود . این مقدار گرمای آزاد شده را گرمای نهان ذوب آن می نامند .
– قانون پنجم : افزایش فشار وارد شده بر سطح هرمایع ، سبب بالا رفتن نقطه انجماد آن می شود . ( زیرا عمل منجمد شدن با کاهش حجم همراه است و فشار عامل کاهش دهنده حجم است . ) مگر در مورد مایع هایی مانند آب ، چُدن مذاب ، بیسموت مذاب که به هنگام یخ زدن دچار افزایش حجم می شود .
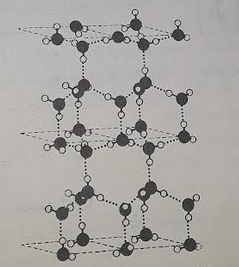
انجماد و قانون های حاکم بر آن





برای نوشتن دیدگاه باید وارد بشوید.