قانون آووگادرو ، از آن جایی که در کتاب درسی به این موضوع در حد خودش اشاره نشده ، لازم دانستم که در باره آن قدری توضیح دهم . تا مورد استفاده مدرسین و دانشجویان شیمی قرار بگیره برای به روز کردن مطالب آموزشی که قبلا مطالعه کرده بودند .
می دانیم که قانون آووگادرو به نظریه مولکولی گازها مربوط است .
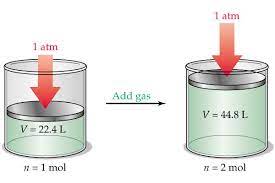
« در شرایط یکسان ، در حجم های برابر از گازهای متفاوت ، تعداد مولکول های برابر وجود دارد . »
اگر شرایط را استاندارد ( STP ) در نظر بگیریم ، می دانیم که در این شزایط حجم یک مول گاز برابر 22.4 لیتر است .
با توجه به رابطه عمومی گازها : و علم به این که فشار 1 اتمسفر و R یا ثابت عمومی گاز برابر 0.082 لیتراتمسفر بر مول کلوین و ذمای کلوین هم برابر با 273 باشد . داریم که :
تعداد مولکول های گاز در این شرایط برابر است که این عدد با تقریب 30% توسط میلیکان ، و بعدها با تقریب 1 درصد و 0.01 درصد به روش تجربی توسط فیزیکدان ها به دست آمده است .
میلیکان این عدد را از تقسیم کردن عدد فارادی بر بار الکترون به دست آورد .
حجم شامل این تعداد از مولکول های گاز را در هر شرایطی حجم مولی گاز می نامیم . مشخص است که حجم مولی گاز ها در شرایط استاندارد برابر :
خواهد بود .
اما با تغییر شرایط می توان حجم مولی گاز را با توجه به قانون عمومی شارل گیلوساک حساب کرد که بیان می کند :
با بهره گیری از قانون آووگادرو ، روشی برای تعیین چگالی نسبی گازها یا بخار اجسام و نیز روشی برای تعیین جرم مولکولی و فرمول مولکولی گازها ابداع و ارائه شد .
چکالی یک گاز نسبت به گاز دیگر در واقع نسبت جرم حجم های برابر از آنها است . اگر این حجم را حجم مولی گا زها ( در شرایط یکسان ) در نظر بگیریم ، چون جرم هر مول گاز ، همان جرم مولی ( یا جرم مولکولی : M ) آن است ، بنابر این می توان نوشت :
چرون جرم مولکولی هوا را برابر M=29 در نظر می گیرند . ( زیرا جرم هر یک لیتر هوا تقریبا برابر1.3 گرم است . )
پس از کشف این واقعیات ، قانون ترکیب حجمی گازها ( گی لوساک ) مطرح شد که بر اساس آن ، گازها در دما و فشار ثابت با نسبت های حجمی معین با یکدیگر واکنش می دهند و این نسبت ها با ضریب مولی آنها متناسب است . در واکنش :
بر اساس قانون گی لوساک در دما و فشار ثابت ، هر مول گاز نیتروژن در واکنش با یک مول گاز اکسیژن ، دو مول گاز نیتروژن مونوکسید می دهد .




برای نوشتن دیدگاه باید وارد بشوید.